Pengertian
Entalpi adalah istilah dalam termodinamika yang menyatakan jumlah energi internal dari suatu sistem termodinamika ditambah energi yang digunakan untuk melakukan kerja. Dari tinjauan, entalpi tidak bisa diukur, namun yang bisa dihitung adalah nilai perubahannya. Secara matematis, perubahan entalpi dapat dirumuskan sebagai berikut:
ΔH = ΔU + PΔV
di mana:
H = entalpi sistem ( joule )
U = energi internal ( joule )
P = tekanan dari sistem ( Pa )
V = volume sistem ( m3 )
Entalpi = H = Kalor reaksi pada tekanan tetap = Qp
Perubahan entalpi adalah perubahan energi yang menyertai peristiwa perubahan kimia pada tekanan tetap.
Perubahan entalpi adalah perubahan energi yang menyertai peristiwa perubahan kimia pada tekanan tetap.
| a. | Pemutusan ikatan membutuhkan energi (= endoterm) Contoh: H2 ® 2H - a kJ ; DH= +akJ | |||
| b. | Pembentukan ikatan memberikan energi (= eksoterm) Contoh: 2H ® H2 + a kJ ; DH = -a kJ |
Perubahan entalpi pembakaran standar
adalah perubahan entalpi total pada suatu sistem reaksi ( dimana rekatan dan produk reaksi dinyatakan sebagai sistem termodinamik ) yang terjadi ketika satu molekul bereaksi sempurna dengan oksigen yang terjadi pada 298K dan tekanan atmosfer 1 atm. Umumnya, nilai entalpi pembakaran dinyatakan dalam joule atau kilojoule per satu mol reaktan yang berekasi sempurna dengan oksigen.
Hampir semua reaksi pembakaran akan menghasilkan nilai perubahan entalpi negatif (ΔHcomb < 0).
Perubahan entalpi pembakaran standar dinyatakan dalam  or
or
 or
or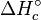
Source : http://technologykimiaherisantoso.blogspot.com/




.jpg)
.jpg)

0 komentar:
Posting Komentar